O elétron é uma partícula fundamental, pois não é composto por outras partículas elementares, pertence ao grupo dos férmions e é classificado como um lépton. Sendo assim ele possui spin fracionário de ½ e carga negativa, o que não permite que 2 elétrons ocupem o mesmo estado quântico. Ele é uma partícula muito pequena, sendo que sua massa é quase 2000 vezes menor que a do próton.
Um dos fatos mais intrigantes sobre os elétrons é que, mesmo que sua massa seja tão pequena, ele pode se comportar como uma partícula, mas também pode se comportar como uma onda, logo ele pode se chocar com outras partículas ou ser difratado, como ocorre com a luz.
Quem identificou o elétron como partícula foi Joseph Thomson, com o experimento de raios catódicos. O experimento consistia em um tubo de vidro evacuado, ou seja, praticamente sem gás algum em seu interior. No interior do tubo havia um eletrodo positivo e um negativo, os quais passava-se uma tensão muito alta. Note que, nesse período, fim do século XIX, as pessoas já conheciam a eletricidade, mas consideravam a mesma como um fluído, pois não sabia da existência dos elétrons. O interessante do tubo catódico é que os raios emitidos em seu interior se chocavam com uma camada de fósforo na outra extremidade e, dessa forma, eram geradas faíscas, o que indicava que os raios haviam sido emitidos em linha reta.
Thomson então resolveu colocar no corpo do tubo, por onde iria passar os raios emitidos dois imãs fortes, sendo que possuíam polos opostos. O fenômeno gerado foi muito interessante, uma vez que o raio foi desviado na direção do polo positivo, indicando que esses raios possuíam carga negativa e que deveriam ser compostos por partículas. E ele estava certo, sendo que o nome elétron foi aceito universalmente.
Com a descoberta do elétron, também foi possível determinar o próton, sendo uma partícula com muito mais massa que o elétron e de carga positiva. Isso fez com que Thomson elaborasse um modelo para o átomo, no caso, o chamado pudim de passas, que era composto de uma superfície positiva cravejada de cargas negativas. Thomson sabia que o átomo era neutro e que possuía uma massa muito maior do que a de elétrons, o que lhe conferiu essa ideia de um pudim de passas, uma vez que esse doce tem bastante massa, mas as passas são muito evidentes em sua superfície.
Alguns anos depois Ernest Rutherford fez o famoso experimento da folha de ouro, em que montou um aparato circular com filme em sua superfície e no centro do raio uma folha muito fina de um metal denso, no caso o ouro. Ele disparou um feixe de partículas alfa sobre essa folha e esperava que as partículas fossem refletidas no filme a frente da folha de ouro, entretanto, o filme atrás da folha ficou marcado, indicando que as partículas haviam passado livremente. Esse fato trouxe a luz que os elétrons não se encontram cravejados sob uma superfície sólida e carregada positiva, mas sim, se encontram livres em órbitas ao redor de um núcleo, sendo assim, haveria muito espaço entre os elétrons e os prótons. Esse raciocínio fez com que Rutherford atualizasse o modelo atômico, sendo agora um modelo com órbitas.
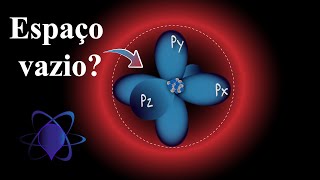
Com o passar do tempo novos modelos foram propostos, como o de Bohr e depois o modelo quântico de Schroedinger, que especificaram que existia a necessidade de uma energia específica que mantivesse os elétrons nas órbitas, sem permitir o choque dos mesmos com o núcleo positivo e de que os elétrons não podem ser pontuados no espaço, sem alterar a sua energia, velocidade, trajetória e posição. Sendo assim, torna-se muito mais coerentes trabalhar com a ideia de densidade de probabilidade para encontrar um elétron no espaço ao redor de um núcleo atômico.
__________________________________________________________________________
Link de afiliação da Amazon para o livro "Pálido Ponto Azul": https://amzn.to/3FfsOzP
__________________________________________________________________________
O canal Ciência Química! tem como objetivo sempre trazer informações científicas com grande enfoque na Química. Nos nossos vídeos você irá encontrar: Ciência geral, divulgação científica, química, astronomia, paleontologia, epistemologia, história da ciência, ensino científico, estratégias de ensino de ciências e vida acadêmica.
Abaixo estão as redes sociais do canal:
Facebook: / cienciaquimica1
Blog: https://licenciandoemquimica.blogspot...
Site sobre o meu doutorado: https://exposicaomuseal.wixsite.com/e...
Não se esqueça de interagir na comunidade do canal Ciência Química!
Agenda do Canal:
Toda terça-feira: Vídeos sobre curiosidades científicas.
Em quintas-feiras alternadas: Respostas de perguntas de inscritos sobre assuntos científicos e acadêmicos feitos na comunidade do YouTube desse canal.
Sextas ou Sábados: Miniaulas de Química ou dicas sobre o mundo acadêmico.









Информация по комментариям в разработке